|
SG116 Balmer-Serie beim Wasserstoff-Atom ©
H. Hübel Würzburg 2013-2024
|
Impres-sum |
Wird Wasserstoff-Gas durch eine elektrische Entladung mit
einer Spannung von wenigen kV zum Leuchten angeregt, dann sendet es
Licht bestimmter Farben bzw. Frequenzen oder Wellenlängen aus. Es gibt
eine einzige Serie von Spektrallinien im Sichtbaren, die Balmer-Serie.
Sie wurde nach ihrem Entdecker benannt. Wie wir heute wissen, entstehen
die verschiedenen Linien dieser Serie dadurch, dass H-Atome aus einem
höher angeregten Energiezustand in einen tieferen Zustand mit der
Hauptquantenzahl n = 2 übergehen. Beim Übergang von m = 3 nach n =
2 entsteht die langwelligste Linie der Balmer-Serie (rot). Die
zugehörigen Photonen haben die geringste Energie. *)
Zwischen Frequenz f bzw. Wellenlänge λ des ausgestrahlten Lichts und der Energiedifferenz ΔE zwischen beiden Energiezuständen Em und En besteht die Beziehung:
| ΔE = Em - En = h·f = h·c/λ (c Vakuumlichtgeschwindigkeit; h Planck'sches Wirkungsquant) |
 |
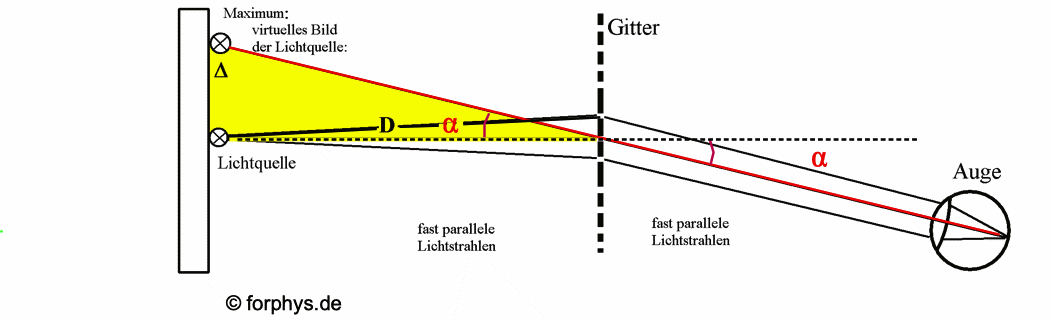
Abb. 1: Betrachtung einer schlitzförmigen Lichtquelle durch ein Beugungsgitter in großer Entfernung. Die rote Linie markiert die Lage des virtuellen Bilds der Lichtquelle auf dem Maßstab. Auf dem Maßstab in der Lichtquellen-Ebene kann die Ablenkung Δ abgelesen werden, die zum "Ablenkungswinkel" α und zur Wellenlänge λ führt ("subjektive Betrachtungweise"). |
 |
Abb. 2: Interferenzfigur nach Abb. 1 erzeugt
durch ein mit Wasserstoff-Gas gefülltes Geißler-Röhrchen und einem
hochauflösenden Beugungsgitter
in "subjektiver Betrachtungsweise. " Man erkennt auf
dem Foto ab der 1. Ordnung die rote und die türkisfarbene Linie. Ein solches Spektrum heißt Linienspektrum. Die Linien sind dabei farbige "Bilder" der linienförmigen Lichtquelle. Wäre die Lichtquelle punktförmig, würde das Spektrum aus farbigen Punkten bestehen. |
Aus den Frequenzen der Balmer-Serie lässt sich auf Energiestufen im Atom schließen. Das gelang Bohr 1913.
(Für "Experten": Vgl. Bohr'sches Atommodell - ein Revival? Entdeckung der Energiestufen des H-Atoms mit einem Tabellenkalkulationsprogramm).
Andere Serien im nicht sichtbaren Bereich:
Endzustand n = 1 : Lyman-Serie im UV-Bereich
Endzustand n =3 : Paschen-Serie im IR-Bereich
und weitere
 |
Abb. 3: Anordnung zur "subjektiven Betrachtungsweise nach Abb. 1 für einen Schülerversuch. Eine Schülergruppe nach der anderen ermittelt auf dem Lineal die Ablenkung Δ der Wasserstofflinien und errechnet daraus den "Ablenkungswinkel" α und damit die Wellenlänge λ. |
 |
Abb. 4:So siehst du das Wasserstoffspektrum mit einem hochauflösenden Beugungsgitter im Schülerversuch nach Abb. 3. Du siehst die rote und die türkisfarbene Linie gut. |
 |
Abb. 5: Mit einer modernen Balmer-Röhre erzeugtes Spektrum. Die Messung der Ablenkung Δ erfolgt hier mit einem Papiermaßstab hinter der Lampe etwas improvisiert. |
*) Normalerweise ist Wasserstoff-Gas in einer Gasentladungsröhre (Geißler-Röhrchen) ein molekulares Gas aus H2-Molekülen. Durch die Gasentladung bei angelegter Hochspannung werden aber auch H2-Moleküle in H-Atome zerlegt ("dissoziiert"). Das von den Atomen ausgesandte Spektrum überlagert dann das Molekülspektrum. Es gibt auch spezielle Entladungsröhren, bei denen die atomaren Spektren im Vordergrund stehen.
Für die Beobachtung der Spektren atomarer Gase braucht man eine Gasentladungsröhre, gefüllt mit dem atomaren Gas.
Molekulare Gase haben sehr komplizierte "Bandenspektren".
Glühende feste Körper senden zwar auch Licht aus; sie haben aber ein
"kontinuierliches Spektrum", d.h. in einem ganzen Wellenlängen-Bereich
ohne Lücken wird Licht ausgestrahlt. Will man also die Zusammensetzung
eines Metalls durch Spektralanalyse bestimmen, z.B. von Natrium, muss
man Stäubchen des Metalls in Gasform bringen, also z.B. verdampfen. Im
Linienspektrum von gasförmigem Natrium dominieren dann zwei dicht
beieinander liegende gelbe Linien.
.
( Juni 2014; Februar 2021: Gesetzmäßigkeit ergänzt; April 2022: allgemeinere Spektren erwähnt )