 |
Unter Phasen eine Stoffes versteht man
einheitliche (homogene) Bereiche, die gegeneinander durch
Trennflächen abgegrenzt sind.
Bei Wasser von Raumtemperatur in einem
teilweise gefüllten Gefäß liegen zwei solche Phasen vor, die
flüssige Phase des Wassers und die gasförmige Phase des
Wasserdampfes darüber. Die meisten Stoffe können in der
festen, flüssigen oder gasförmigen Phase vorkommen.
Es gibt aber noch verschiedene andere Phasen.
Vielleicht hast du im Chemie-Unterricht die Phasen von
flüssigem oder festem Schwefel mit unterschiedlichen
Modifikationen von Schwefel kennengelernt. Es gibt auch noch 3
gasförmige Schwefelphasen.
|
Eng verwandt mit dem Begriff der Phase ist der Aggregatszustand.
Von den meisten Stoffen kennen wir den festen, flüssigen und gasförmigen
Aggregatszustand. Manche fassen auch ein Plasma
mit getrennt sich bewegenden negativen und positiven Ladungen als 4.
Aggregatszustand auf. Eis, Wasser und Wasserdampf sind ein dir bekanntes
Beispiel für ein und denselben Stoff. Nebel dagegen besteht aus kleinen
Wassertröpfchen in Luft. Hier liegt Wasser überwiegend in der flüssigen
Phase vor, aber, da ein Teil des Wassers verdampft ist, auch in der
gasförmigen Phase. Auch das Kohlendioxid (CO2) der Luft
kann verflüssigt werden. Es wird in dickwandigen "Gasflaschen" verkauft,
und wenn du das Ventil öffnest strömt Kohlendioxid aus, kühlt sich stark
ab (Vorsicht: "Verbrennungs-"Gefahr!) und wird zu festem
Kohlendioxid-Schnee, der auch nach und nach verdampft, wobei er die
flüssige Phase überspringt (Sublimation). Trockeneis ist festes
Kohlendioxid.
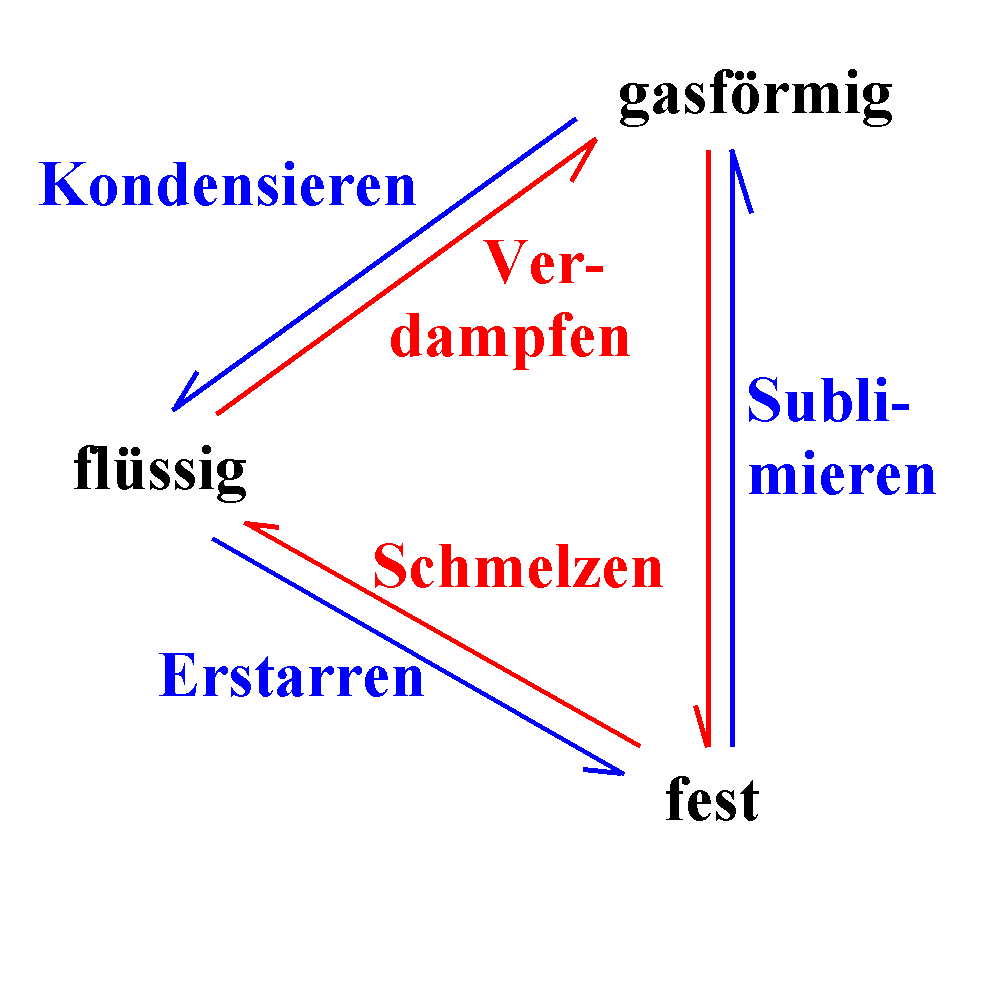
Phasenübergänge sind ein etwas allgemeinerer Fall
von Änderungen des Aggregatszustands.
Änderungen des Aggregatszustands können unterschiedlich
durchgeführt werden. Gemeinsam ist allen Änderungen eine Energiezufuhr
(für den Weg fest-flüssig-gasförmig) oder ein Energieentzug (für den Weg
gasförmig-flüssig-fest). Wasserdampf z.B. wird flüssig, wenn du ihn bei
1000C abkühlst (Energieentzug) oder wenn du den Druck
erhöhst. Ähnlich wird flüssiges Wasser fest, wenn du es bei 00C
abkühlst (Energieentzug). Wenn du aber bei 00C den Druck
erhöhst, wird das Eis wieder flüssig ("Anomalie des Wassers").
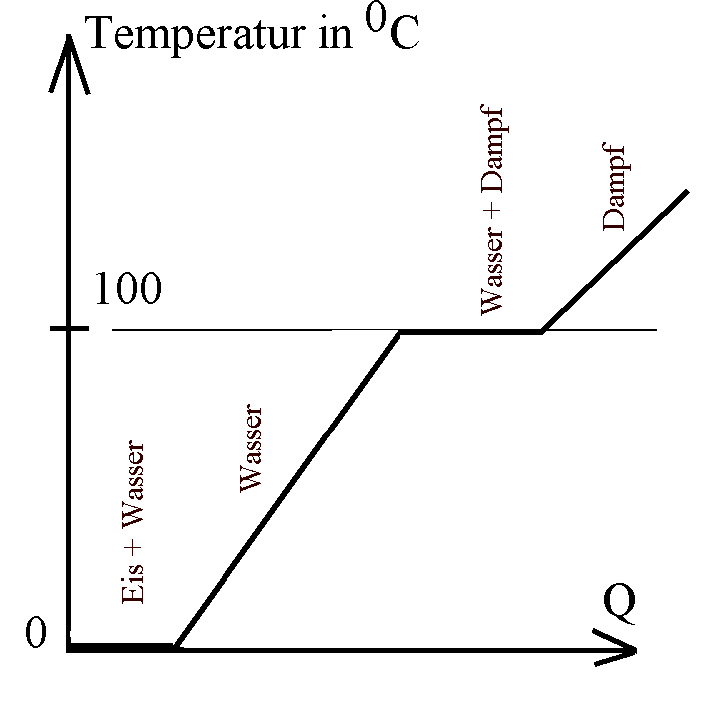 |
Temperatur von Wasser in Abhängigkeit von der
zugeführten Wärme Q (Prinzipdarstellung):
Charakteristisch für Änderungen des
Aggregatszustands ist die Konstanz der Temperatur
während des Erstarrens bzw. des Schmelzens bzw. während
des Kondensierens bzw. Siedens (Verdampfens). Reines
Wasser unter Idealbedingungen erstarrt bei einer festen
Temperatur von 00C und siedet bei einer festen
Temperatur von 1000C (Kurve links idealisiert).
Erhitzt du fein zerstampftes Eis (Energiezufuhr
bei 00C; unter Idealbedingungen) unter sorgfältigem
Umrühren, dann bleibt die Temperatur konstant bei 00C,
bis alles Eis geschmolzen ist. Erst bei weiterer Energiezufuhr
steigt die Temperatur des flüssigen Wassers weiter an.
Erhitzt du also flüssiges Wasser von 1000C
vorsichtig unter kräftigem Umrühren (Energiezufuhr bei 1000C),
so bleibt die Temperatur konstant 1000C, bis alles
Wasser verdampft ist. Erst bei weiterer Energiezufuhr steigt
die Temperatur des Dampfes weiter über 1000C an.
Bereits unterhalb von 1000C
verdunstet ein Teil des
Wassers, so dass in Realität die Erwärmungskurve unterhalb
von 1000C flacher wird und "gerundet" in die
Horizontale einmündet.
|
In einer Flüssigkeit wie Wasser bewegen
sich die Teilchen unregelmäßig hin und her. Die meisten Teilchen
bleiben durch Kräfte aneinander gebunden und können den Verband der
Flüssigkeit nicht verlassen. Einige Teilchen erreichen z.B. bei Stößen
aber soviel Energie, dass sie die anziehenden Kräfte überwinden und
die Flüssigkeit verlassen können. Sie treten in den Dampfraum über.
Man sagt, die Flüssigkeit bildet eine Phase (A), der Dampf eine Phase
(B). Dann existiert das Wasser gleichzeitig als Flüssigkeit und als
Gas (Wasserdampf *)).
Der Übergang
kann ohne Energiezufuhr von außen geschehen. Dann nennt man den Vorgang
"Verdunstung". Die Flüssigkeitsphase wird dadurch immer
energieärmer: die mittlere Energie eines jeden ihrer Teilchens sinkt;
die Temperatur sinkt, die Flüssigkeit kühlt sich ab. Denn zur
Überwindung der gegenseitigen Anziehungskräfte wird Energie benötigt.
Das geschieht bereits unterhalb der Siedetemperatur.
Man könnte der Flüssigkeit aber auch Energie zuführen.
Wieder verlassen die energiereichsten Teilchen die Flüssigkeitsphase,
wobei sie die zugeführte Energie mitnehmen. Diesen Vorgang nennt man "Sieden".
Die mittlere Energie der Flüssigkeitsteilchen bleibt konstant, ebenso
ihre Temperatur, bis alle Flüssigkeit "verdampft" ist.
Den umgekehrten Vorgang, wenn also Teilchen aus dem Dampf
wieder in der Flüssigkeit gebunden werden, nennt man "Kondensieren".
Die überschüssige Energie müssen die Teilchen abgeben. Es wird
Kondensationswärme frei, u.U. gefährlich viel.
Z.B. in einem abgeschlossenen Gefäß können Flüssigkeit und
Dampf durch den ständigen Austausch von Teilchen im thermischen
Gleichgewicht stehen. Dann haben Flüssigkeit und Dampf gleiche
Temperatur. Es kann aber auch sein, dass dieses Gleichgewicht gestört
ist. Das könnte z.B. geschehen, wenn der Dampf abgesaugt oder durch
einen Luftzug entfernt wird. Dann kühlt sich die Flüssigkeit immer
stärker ab, weil immer mehr Teilchen in die Dampfphase übergehen.
*) Wasserdampf ist
unsichtbar. Wenn sich Nebelschwaden bilden, handelt es sich um fein
verteilte Tröpfchen von flüssigem Wasser.
(September 2013)

